24小时服务热线
13007546599
服务热线:13007546599
服务项目
Products Classification医学监察是什么?医学监察是临床研究过程中监查工作的重要组成部分,与临床监查、数据监查及安全相互补充,验证并确保受试者的权利和福祉受到保护,试验数据质量符合方案、GCP和其他监管要求。医学监察员,也叫临床监查员(CRA),不仅需要有专业知识基础,也需要熟悉适当的法律法规,具有数据管理、分析与总结的能力,还需要具备项目管理,团队合作,沟通谈判的软实力。
依据《医疗器械临床试验质量管理规范》第一条的规定,临床试验监查的目的是为了加强对医疗器械临床试验的管理,在维护医疗器械临床试验过程中受试者权益,保证医疗器械临床试验过程规范,结果真实、科学、可靠和可追溯的前提下,督促临床试验顺利完结。
岁福是老牌的第三方临床试验CRO公司,拥有专业的监查和培训团队,建立了一整套医疗器械临床试验监查和培训的全面的标准操作规程。本监查专项服务涵盖需临床的医疗器械产品和IVD体外诊断试剂产品,通过项目监查、提供咨询和培训,确保参与临床试验的各个机构都能按照GCP(或ICH-GCP)、标准操作规程(SOP)和相关法规要求实施临床试验。
1、监查公司的专业团队可弥补临床试验机构的不完善;
2、监查公司的独立性可以监督CRO公司的临床试验质量;
3、监查公司的专业团队可以为医药企业提供专业的技术咨询服务。
这就是岁福在公司成立之处,设立临床试验监查团队的初衷。
临床监查员的工作可以涵盖整个临床试验,即从方案设计开始到研究总结报告完成。大部分工作涉及研究相关问题和方案问题。例如:
1、回答研究中心、CRA和研究团队的入排标准问题;
2、在研究开展过程中回答关于研究方案的问题;
3、与研究中的其他人员协调,以确保信息的一致性;
4、解决来自研究中心和研究团队在整个研究中的安全问题;
5、在受试者因医疗紧急情况需要揭盲时确认并提供指导;
6、审核事件编码列表;
7、研究与方案相关的培训。
临床试验入组20%病例(及早发现问题,通过加强培训,避免问题再次发生);
最后一例受试者出组(在收表前发现问题,避免过多的统计学答疑);
总结报告生成后,临床总结会之前(总结报告、统计分析报告与原始资料的数据不一致是常见问题)。
项目经理、协调员和监查员是临床试验中最为关键的三个角色,临床监察员代表的是申办方的利益,岁福坚决维护申办方的利益,我们为受试者负责,也为申办方临床项目负责。岁福承诺,我们的监查员重视审核签名页,确保数据的真实、准确、完整,绝不弄虚作假。
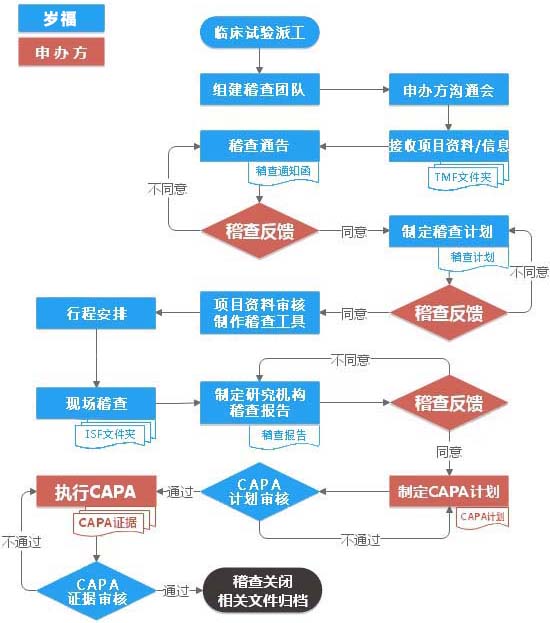
监查费用由第三方临床监查服务商收取,官方不收取费用。
| 岁福器械CRA收费标准 | |
| 需做医疗器械临床产品类别 | CRA收费标准 |
| 二类器械 | 600-800元/例 |
| 三类器械 | 1200-1500元/例 |
| 具体报价,依据样本收集难易程度、项目难易程度等因素判定,有可能高于上述费用。 | |
| 文件名称 | 文号 | 发布时间 | 实施时间 |
|---|---|---|---|
| 《医疗器械监督管理条例》 | 650号文件 | 2014-3-7 | 2014-6-1 |
| 《医疗器械注册管理办法》 | 药监总局令4号 | 2014-7-30 | 2014-10-1 |
| 《医疗器械临床试验质量管理规范》 | 药监总局令25号 | 2016-3-23 | 2016-6-1 |
| 阶段 | 说明及时限 |
|---|---|
| 监查准备至现场监查开始 | 收到项目资料后1个月内 |
| 现场监查 | SDV抽样下,2个WD/家 |
| 监查报告 | 最后一家机构现场监查完成后3个WD |
| CAPA计划审核 | CAPA计划获得后2个WD |
| CAPA证据审核 | CAPA证据获得后2个WD |
| 服务项 | 具体工作内容 |
| 第三方独立监查 |
1、调研、选择、提供试验中心和研究者相关信息; 2、获得临床文件及伦理委员会批件,对伦理会批件初审; 3、组织研究者会议作会议记要,接待研究者工作; 4、严格按照GCP、SOP、试验方案和法律、法规,按时完成研究中心的选择、启动、常规监查、和中心关闭; 5、高质量的研究中心访视报告; 6、协助研究中心进行AE/SAE的报告,跟踪随访; 7、核查知情同意过程,确保受试者安全及利益; 8、原始数据核查,对各类数据负责; 9、试验器材文件管理; 10、监查前工作准备,监查报告反馈、整改。 |
| CAPA计划可行性审核 | |
| CAPA证据有效性审核 |
站点声明:
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
河南岁福医疗科技有限公司专注于医疗器械、诊断试剂产品政策与法规规事务服务,提供产品注册申报代理、临床合同(CRO)研究、GMP质量辅导等方面的技术外包和生产许可证、经营许可证及临床机构备案办理服务。

上一篇:没有了
下一篇:没有了

