24小时服务热线
13007546599
服务热线:13007546599
8月初欧盟的医疗器械顾问机构Medical Device Coordination Group (MDCG),发布了针对新冠试剂的临床试验指导文件(MDCG 2021-21 Guidance on performance evaluation of SARS-CoV-2invitro diagnostic medical),这个指导文件填补了欧盟自新冠爆发以来一直缺少针对新冠试剂临床试验标准的空白。
对于中国600多家在欧洲市场已经拿到不同国家的白名单、CE自我声明(DOC)、或者正在申请NB公告机构CE认证,甚至已经拿到NB公告机构CE认证的企业来说,这个临床试验指导文件意义重大。这个临床试验指导文件将决定还有几家企业能继续留在这个市场。
面对欧盟现有的体外检测法规IVDD(Directive 98/79/EC)在2022年5月26号将退出,新的指导IVDR(Regulation (EU) 2017/746)即将实施,这个临床试验指导文件将如何被执行,被执行的后果是什么,大部分中国IVD企业目前还没有反应过来。
什么样的新冠试剂需要按照新的指导文件做临床试验,什么样的新冠试剂不需要?目前正在进行的临床试验需要按照指导文件,重新做临床吗?已经获得NB公告机构CE认证的新冠试剂,需要按照这个指导文件补做临床数据吗?

新冠试剂是一个新的IVD产品,欧洲现有的IVDD对于这个产品没有现成的申请流程和技术标准,又因为缺少美国FDA的紧急授权(EUA)的模式,欧洲只能一边让各个国家通过自己的标准来解决市场需求,一边建立新的流程,还要顾及到明年IVDR新法规的相互兼容。
从今年5月份开始,欧洲各国针对新冠抗原产品用于本国的“白名单”临时豁免应急审批机制,基本已关闭。
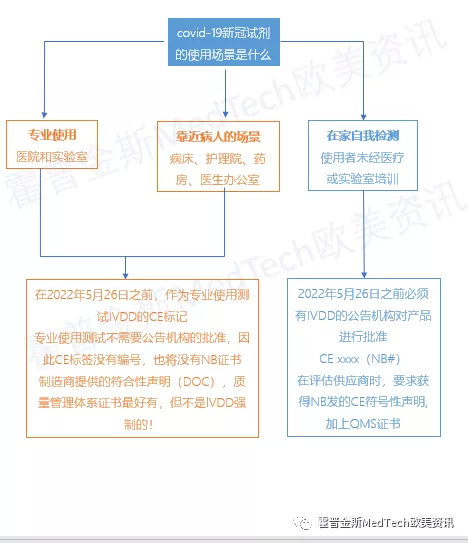
针对新冠试剂的不同使用场景,欧盟对于试剂的认证流程做了新的规定,对于新冠试剂的使用场景是什么,做了规定包括:
1、医院、实验室的专业使用
2、靠近病人的使用场景:病床、护理院、药房、医生办公室
3、在家自我检测,使用者是未经医疗或实验室培训的普通人
2022年5月26日之前,
作为专业场所使用的新冠试剂,不需要公告机构的批准,就可以使用IVDD的CE标志,因此CE标签没有编号,也将没有NB证书,制造商只需要提供符合性声明(DOC),最好有质量管理体系证书QMS,但不是lVDD强制的!
对于在家自我检测的新冠试剂,必须有IVDD的公告机构对产品进行批准的CE,制造商要获得NB发的CE符号性声明, 加上QMS证书,才可以在欧洲市场销售。
随着IVDR强制执行时间临近(官方2022年5月27日),对于在家自我检测的新冠试剂,IVD企业有两个选择:
第一是在2022年5月26日前通过IVDD 申请流程获得NB公告机构的CE认证,这样的话IVDD在2022年5月26日后还有2年的过度期,可以一直使用到2024年。
第二个选择就是等待新的IVDR新冠试剂的申请流程再开始申请。
对于医院和实验室用的专用版新冠试剂,IVD企业不需要通过NB就可以使用CE标志在欧洲进行销售,但是2022年5月27日实施的新IVDR有可能会改变这个规则。这是中国的IVD制造商需要注意的。
不过,中国的IVD制造商在欧洲市场主打的产品是在家自我检测的抗原新冠试剂。
但是随着MDCG新冠试剂临床试验指导文件的发布,一切又发生了变化。
MDCG新冠试剂的临床试验指导文件提供了新冠试剂临床试验的详细要求。
这个最新的指导文件主要针对新冠检测试剂在欧洲的临床试验的具体要求,不管是现在的IVDD(Directive 98/79/EC),还是明年5月27号即将启用的IVDR(Regulation (EU) 2017/746)都需要遵循这个临床试验指导文件。
这个临床试验的标准,覆盖了3种不同的新冠试剂,即抗原、抗体和核酸试剂、使用场景包括了专业用或者自我检测等所有场景。
那么对于实验室用的专业版新冠试剂,即使是IVD企业自己可以做自我声明(DOC), 根据这个文件,IVD企业还是必须严格的进行临床试验,并且符合指定文件的标准。
在这个指导文件公布后,欧盟要求所有制造、经销、消费和认证新冠试剂的机构,都需要遵从这个新冠试剂的临床试验指南,包括制造商、欧洲的医疗经销商、认证公告机构(NB)、欧代、专业的医疗机构。
这个的临床试验指南也将成为明年开始实施的IVDR的common specifications的基础。当然欧盟起草小组也在文件中指出了,在未来对抗新冠的过程中,有新的科学和技术新发现,这个指南也是会做调整的。
新的指导文件完善了新冠试剂临床试验的审核标准,同时各个公告机构要求已获得在家自我测(Self-test)试剂CE证书以及计划要获得新冠在家自测(Self-test)CE证书的企业,涉及临床试验都必须要按照这一指南进行。
并且对于已经拿到IVDD新冠试剂自我检测证书的企业,可能将被公告机构要求按照新指南补充临床数据资料,否则会被取消证书。
对于曾经在欧洲的新冠检测市场中赚的盆满钵满的中国IVD企业,以及还希望进攻欧洲市场的IVD企业来说,这个新的临床试验指导文件,让进入欧洲市场的门槛一下子提高了很多。
新的临床试验要求非常高,包括阳性对照组试剂的要求,必须是已获得欧盟认证的产品,临床样本量比美国FDA的要求还多,样本类型的范围也非常广泛,需要阳性、弱阳性、阴性、患有其他呼吸道疾病阴性、可能阴性的,以及接种疫苗等情况的样本都需要考虑。
对于在家自测的新冠试剂,使用的样品必须是取自当天来做检测的志愿者,不可以使用冰冻的样品。
虽然没有明文写着必须在欧洲进行临床试验,但是临床志愿者必须与欧洲人群等同,这点就决定了临床试验必须是在欧洲或者是在美国进行。
根据作者和欧盟几家NB公告机构最近的沟通,在美国进行的临床数据是可以用于这个新的临床试验要求的,虽然MDCG还是要求临床试验包括部分的欧洲数据。
来源:霍普金斯MedTech欧美资讯-荷马
站点声明:
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
河南岁福医疗科技有限公司专注于医疗器械、诊断试剂产品政策与法规规事务服务,提供产品注册申报代理、临床合同(CRO)研究、GMP质量辅导等方面的技术外包和生产许可证、经营许可证及临床机构备案办理服务。

相关文章

