24小时服务热线
13007546599
服务热线:13007546599
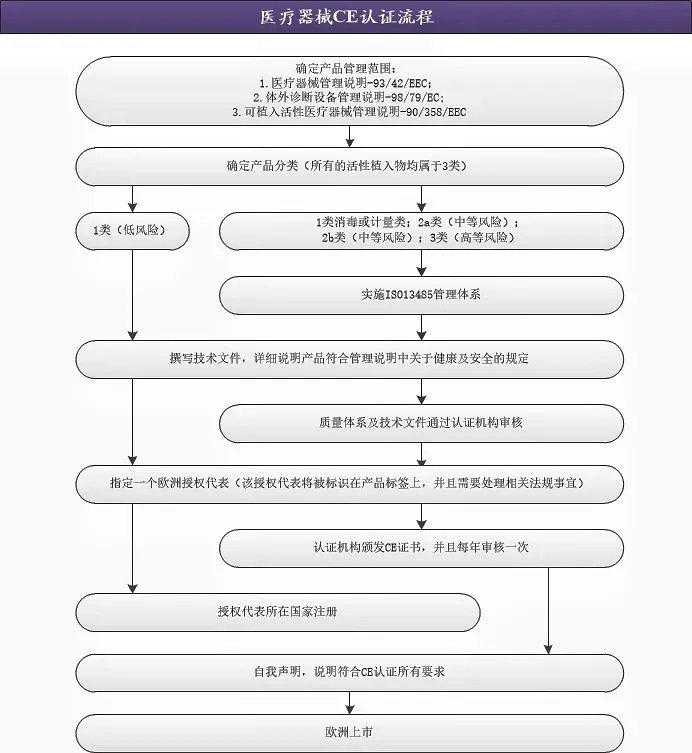
欧盟符合性声明是一个很重要的文件,是企业在确认该产品符合欧盟医疗器械法规后,对外宣称该产品符合欧盟医疗器械法规的文件,必要时需要向相关单位提供该文件。所以企业相关人员在做CE认证一定要对欧盟符合性声明要有一定的了解和掌握,今天小编就在这里给大家讲讲这方面的知识,赶快收藏吧,非常重要哦!

CE标志制度是欧盟对产品进入欧盟市场进行的监管方式。加贴CE标志的产品表明产品符合欧盟有关安全、健康、环保等法规要求,可以在欧盟27个成员国、欧洲贸易自由区的4个国家、以及英国和土耳其合法上市销售。
欧盟医疗器械法规(MDR)要求制造商要为加贴CE标志的产品签署一份符合性声明(Declaration of Conformity,简称DOC)。
DOC通常和产品的技术文档一起,在CE符合性评定时接受公告机构的评审,或者随时准备接受欧盟成员国主管当局的审查。
1.MDR:说明已履行本法规中的相关涵盖器械规定的要求。
2.IVDR:说明已履行本法规规定要求。
3.制造商应当不断更新欧盟符合性声明。
4.至少应包括列于附录Ⅳ的信息,且应将其翻译成欧盟官方语言或者器械销售所在成员国所要求的语言。
5.就本法规未涵盖的相关问题,若器械需遵守其他欧盟立法机构要求(该立法机构要求制造商发布一份证实已履行该立法机构所规定要求的欧盟符合性声明),只需要起草有关所有欧盟法案均适用该器械的单独符合性声明。这一声明应包含所有相关欧盟立法机构的必要信息。
6.通过起草欧盟符合性声明,制造商应承担遵守本法规和适用于器械的所有其他欧盟立法机构的要求的责任。
7.MDR:委员会应有权按照第115条规定通过授权法案,基于技术进步来修订附录Ⅳ规定的欧盟符合性声明的最低限度内容。
8.IVDR:委员会应有权按照第108条规定通过授权法案,基于技术进步来修订附录Ⅴ规定的欧盟符合性声明的最低限度内容。
1.第31条(MDR)/第28条(IVDR)中所述的制造商的名称、注册商品或注册商标和单一注册号SRN(如签发)(MDR要求)及其授权代表(如适用)和注册营业地点的联系地址。
2.制造商对签发欧盟符合性声明负完全责任的声明。
3.附录Ⅵ第C部分所述的基本的医疗器械唯一标识UDI-DI。
4.产品名称和商品名、产品代码、目录编号或欧盟符合性声明中包含的其他允许识别和追溯产品的明确的参考号,如适当照片,以及适当时其预期目的。除产品或商品名称外,第3条中基本UDI-DI所提供的允许识别和可追溯产品的信息。
5.按照附录Ⅷ的规则划分的器械风险等级。
6.当前声明所涵盖的器械符合本法规,以及适用时其他相关的要求签署欧盟符合性声明的欧盟立法的声明。
7.符合性声明中所用的任何通用规范(CS)的索引。
8.公告机构的名称和标识号(如适用),所执行的符合性评估程序的说明和所签发和证书的标识。
9.如适用,额外的信息。
10.签字人的声明,地址和日期、签字姓名和职务、以及代签人签名。
2017年2月Regulation (EU)2017/745 on Medical Devices医疗器械法规(MDR))提案发布,同年3月,欧盟成员国一致投票表决同意MDR。2017年5月5日,欧盟Official Journal正式对外宣MDR法规内容。MDR新法规将取代现行的有源医疗器械指令Council Directive 90/385/EEC on Active lmplantable Medical Devices (AIMDD)(1990)以及医疗器械Council Directive 93/42/EEC on Medical Devices (MDD)(1993)指令。原计划2020年5月26日正式实施的MDR受全球新冠影响将推迟实施时间至2021年5月26日。
在此期间,仍然可以进行以下MDD证书的相关活动,例如产品变更及一年期内MDD新户的申请;现有MDD客户证书更新的相关活动;现有MDD客户证书更新的申请(包括提前更新的申请);现有MDD客户重大变更的申请期。虽然MDR的正式实施有延期,但是有例外情况如:
MDD产品的投放截止日期仍为2024年5月26日
MDD产品供应截止日期仍为2025年5月26日
对制造商和产品的影响而言,93/42 EEC指令和MDR基本上具有相同的基本监管要求。没有删除现有的需求,但是MDR添加了新的需求,与目前93/42指令相比,MDR更加强调生命周期方法的安全性,并有临床数据支持。MDR对公告机构的指定提出了更严格的要求,对国家主管当局和委员会加强了控制和监测。MDR对某些设备重新分类,范围更广。例如,MDR明确涵盖用于清洁、消毒或消毒其他医疗设备的所有装置(第2.1条);一次性医疗器械(第17条);和某些无医疗用途的装置(附件十六)。MDR还包括在互联网上销售医疗器械以及用于远程提供诊断或治疗服务的医疗器械(第6条)。MDR为一些Ⅱb类器械和植入性Ⅱ类器械引入了由独立专家小组进行的临床评估咨询程序(第54条)。
站点声明:
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
河南岁福医疗科技有限公司专注于医疗器械、诊断试剂产品政策与法规规事务服务,提供产品注册申报代理、临床合同(CRO)研究、GMP质量辅导等方面的技术外包和生产许可证、经营许可证及临床机构备案办理服务。

相关文章

