24小时服务热线
13007546599
服务热线:13007546599
临床试验从头到尾再做一遍很难,为啥?因为成本太大。如果试验方案Protocol中主要评价指标相关的数据没有被采集,那么试验即可等同于失败。
病例报告表(CRF)是研究者依据临床试验方案protocol收集研究数据的电子或纸质版表格,是获取原始数据的主要来源,是仅次于protocol的重要文件。

CRF设计的质量将极大地影响临床研究的后续工作。设计不佳的CRF可能导致临床研究数据点的遗漏、数据录入核查的不利、数据库的修改、随之而来大量不必要的质疑query以及后期统计分析错误率的上升。给诸多同事包括CRF设计者自己,造成不必要的困扰。当然现实中也不允许这种重大“翻车事故”,因为DBD(当然还有DM、统计师、研究者等Study Team其他成员们)不会放过任何错误。
说到CRF,之前分享过eCRF与EDC。今天简单分享下CRF设计流程和注意事项。
1. CRF必须包含试验方案protocol所要求的所有字段,这是CRF设计的基本要求。
2. 不能有冗余字段。
以上两点简而言之就是全面完整、简明扼要。需要的一个不能少,不需要的一个都嫌多。
3. CRF建议符合数据获取协调标准(CDASH),CDASH是CDISC一系列标准中用来简化和规范CRF的标准。
1)CRF中使用CDASH域中极力推荐的变量和推荐/条件变量
2)CRF中的所有代码列表尽可能地使用当前发布的CDISC控制术语极其控制术语子集
3)遵守CDASH的最佳实践建议
4)除非文化和语言原因,尽可能地使用CDASH上的问题文字或提示
4. CRF设计要符合EDC系统的要求,比如不允许出现特殊字符等。
CRF设计应有严格的sop对开发、审核、批准、版本控制及研究中心培训的流程进行控制。CDASH推荐的CRF设计流程:
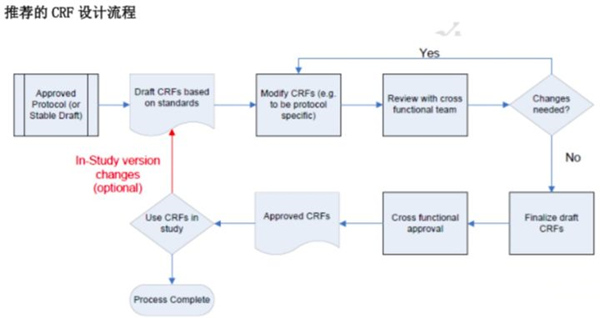
1. 根据完善的临床试验方案设计CRF初稿。
2. 反馈给数据经理,形成第一版定稿。
3.CRF定稿交由参与方案设计的相关人员进行评阅,例如统计、医学、运营、研究者,从各自专业角度提出修改建议,并统一反馈至CRF设计员。如不需要修改直接第二版定稿。
4. CRF设计员根据反馈修改CRF。
5.多方审核并批准。若此步骤后又发生CRF更新,应重新进行审核、批准。
6.应用于临床试验。
作者:达尔文
站点声明:
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
河南岁福医疗科技有限公司专注于医疗器械、诊断试剂产品政策与法规规事务服务,提供产品注册申报代理、临床合同(CRO)研究、GMP质量辅导等方面的技术外包和生产许可证、经营许可证及临床机构备案办理服务。

相关文章

