24小时服务热线
13007546599
服务热线:13007546599
美国食品和药物监督管理局(FDA) 在7月7日确定了关于唯一器械标识(UDI) 的形式和内容要求的最终指南,这是在该指南的草案发布近五年后(2016年7月25日)以及UDI最终规则的发布八年后(2013年9月24日)确定的。
该指南旨在描述“对UDI的形式和内容的要求以及FDA的建议,确保在UDI发布系统下所开发的UDI符合唯一器械标识系统最终规则”。
UDI规则需要每个医疗器械的标签和包装都带有UDI,除非有豁免或替代方案(21 CFR 801.20)。此外,如果器械打算多次使用并需要在每次使用前重新处理,则器械本身需要带有提供UDI的永久性标记(21 CFR 801.45)。UDI规则还包括对医疗器械独立软件的特殊标签要求(21 CFR 801.50)。
UDI规则旨在为医疗器械创建一个标准化的识别系统。正如UDI规则的序言中所述,该系统可以快速、明确地识别器械以及影响其安全和有效使用的些关键属性(78 FR 58786)。
根据UDI规则,每个贴标商必须使用一个或多个由FDA认可的发码机构运营的系统来分配出现在器械标签、器械包装上以及(如适用)器械本身作UDI(21 CFR 801.20, 801.45和 830.20)。为了形成一个有效的识别系统,FDA认可的发码机构必须开发和运行UDI分配系统,以便使用这些系统的标签商能够符合UDI标签要求。
本指南描述了UDI的两种形式、UDI的内容,并说明UDI中特定数据元素的数据分隔符的使用。本指南还以易于阅读的纯文本形式说明了推荐的数据顺序。
“器械唯一标识”被定义为“通过满足 [21 CFR 830.20] 要求,在分销和使用过程中,可以充分识别器械的标识符,”(21 CFR 801.3)。UDI由器械标识符(DI) 和生产标识符(PI) 组成。“器械标识符”被定义为“UDI的固定部分,用于标识器械的特定版本或型号以及该器械的标签”(21 CFR 801.3)。“生产标识符”在21 CFR 801.3 中被定义为“UDI的可变部分,当包含在器械标签上时,可以识别以下一项或多项:
(i)器械制造的批次;
(ii)特定器械的序列号;
(iii)特定器械的有效期;
(iv)特定器械的制造日期;
(v)对于作为器械被监管的HCT/P, 21 CFR 1271.290(c)的特定识别代码。”
根据21 CFR 830.20,UDI必须由FDA认证的发码机构发布并应符合已纳入21 CFR 830.10中关于UDI规则的以下国际标准:
· ISO/IEC 15459-2:信息技术 - 唯一标识符 - 第 2 部分:注册程序;
· ISO/IEC 15459-4:信息技术 - 唯一标识符 - 第 4 部分:单独项目;
· ISO/IEC 15459-6:信息技术 - 唯一标识符 - 第 6 部分:产品分类的唯一标识符。
此外,UDI必须仅使用来自ISO/IEC 646中特定符集的字符和数字:信息技术- ISO用于信息交换的7位编码字符集。
A.UDI的形式
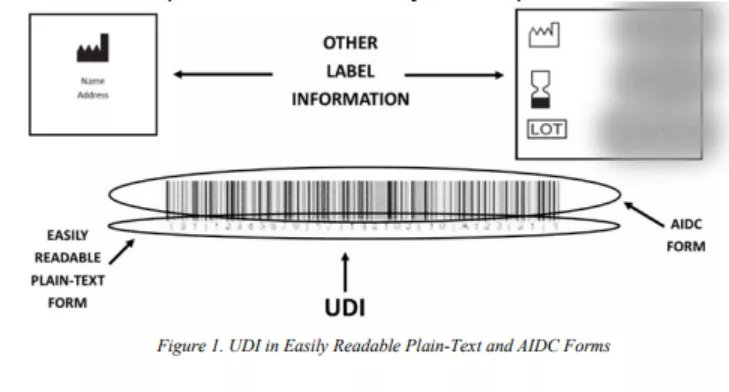
UDI必须以两种形式出现在器械标签和包装上:(1) 易于阅读的纯文本(easily readable plain-text);(2) 自动识别和数据采集(automatic identification and data capture AIDC) 技术(21 CFR 801.40(a))。当器械必须带有UDI作为直接标记时,可以通过易于阅读的纯文本和AIDC技术的一种或两种形式提供UDI,或者通过可以提供UDI的任何替代技术(21 CFR 801.45(C))。
UDI,尤其是通过AIDC技术提供时,旨在实现快速准确的数据采集、记录和检索。易于阅读的纯文本形式允许医疗保健专业人员、患者、FDA和UDI系统的其他用户在没有技术帮助的情况下读取UDI并将其输入数据系统,例如患者病例或向FDA提交的报告。因此,如果无法使用AIDC形式,则易于阅读的纯文本形式可用作获取UDI的额外方法。
图1为易于阅读的纯文本形式和AIDC形式的示例。
B.UDI的内容
我们将“UDI载体”定义为通过使用易于阅读的纯文本和/或AIDC形式来传达UDI和潜在非UDI元素的方法。UDI载体可以包括关于器械所附加的非UDI信息。一些FDA认可的发码机构可能会在UDI载体内数据字符串中包含非UDI元素,例如数量。然而,FDA并不将此类额外的非UDI元素视为UDI的一部分。因此,附加非UDI元素的数据分隔符应不同于UDI中的DI和PI数据分隔符。
根据 21 CFR 801.40(b),UDI的易读纯文本和AIDC形式必须包括:(1)器械标识符段;(2) 当包含在器械标签上时,传达21 CFR 801.3 中“生产标识符”定义中列举的一个或多个标识符的生产标识符段。器械标识符段和生标识符段不能包含非UDI元素或非UDI元素的数据分割符。
UDI规则没有在标签上要求包含有构成PI的五个标识符中的任何一个。然而,其他法规可能要求一个或多个包构成PI的标识符出现在标签上。例如,根据21 CFR 1271.290(c),人体细胞、组织以及细胞和组织产品(HCT/Ps) 的制造商必须使用不同的识别代码来标识。
在某些情况下,UDI可能仅包含一个DI。例如,如果 II 类器械在标签上不包含组成PI的五个标识符中的任何一个,那么UDI中就不需要PI。此外,I 类器械的UDI不需要包含PI(21 CFR 801.30(d))。但是,I 类器械的标签商可以自愿在UDI中包含PI。
C. 数据分隔符
就本指南而言,“数据分隔符”是用于标识UDI载体编码数据字符串中的特定数据元素。数据分隔符用于识别在其之后的信息,数据分隔符因每个FDA认可的发码机构建立的UDI系统而异。
数据分隔符是UDI可理解性和实用性的关键,包含数据分隔符对于UDI的易于阅读的纯文本和AIDC形式都很重要。数据分隔符允许用户以易于阅读的UDI纯文本形式解析DI和PI,并验证以UDI的AIDC形式编码的信息是否与UDI易于阅读的纯文本形式匹配。数据分隔符还使UDI能够在扫描后解析至电子系统。重要的是,数据分隔符允许将UDI与可能在表示的任何非UDI元素区分开来并分别捕获。此外,如果UDI载体中包含非UDI元素,则应包括这些非UDI元素的独立数据分隔符。如果没有适当的数据分隔符来识别非UDI元素,个人可能无法使用UDI的易于阅读的纯文本形式来识别器械,并且计算机系统可能无法通过自动识别来以AIDC形式准确采集UDI。
D. 易于阅读的纯文本形式中的数据顺序
在UDI载体的易于阅读的纯文本形式中,UDI应位于任何非UDI元素之前。UDI的易于阅读的纯文本形式应首先指定DI,然后为PI(如有)。如果UDI载体中有任何非UDI元素,则非 UDI元素应以易于阅读的纯文本形式在PI之后。例如,如果某个器械的标签带有有效期和数量,并且标签商希望将数量包含在UDI载体中,则UDI载体易于阅读的纯文本显示顺序为:DI的数据分隔符,DI,有效期的数据分隔符,有效期PI,数量的数据分隔符,数量。虽然FDA不禁止在UDI载体中包含数量,但数量不被视为UDI的一部分,数量的数据分隔符应与UDI中的 DI和PI数据分隔符不同。
E.独立软件
独立软件根据是否以打包形式分发(21 CFR 801.50)而有不同的标签要求。对于不以打包形式分发的独立软件,只要UDI通过以下任一或两种方式提供并且版本号在其PI中有传达,则符合UDI标签要求:
·每当软件启动时都会显示易于阅读的纯文本语句;
·通过菜单(例如“关于”)显示的易于阅读的纯文本语句(21 CFR 801.50(a))。
对于以打包形式分发的独立软件,21 CFR 801.50(a) 不适用。无论何时启动软件或通过菜单显示(21 CFR 801.50(b)),独立软件必须提供其易于阅读的纯文本的UDI。此外,器械标签和器械包装还必须带有易于阅读的纯文本和AIDC形式的UDI(21 CFR 801.20(a) 和 801.40(a))。如上所述,当制造器械的批次包含在器械标签上时,则批次必须包含在PI中(21 CFR 801.3 和 801.40(b))。“软件版本”包含在21 CFR 801.3 对批次定义里。因此,当需要带有UDI的独立软件的标签商在标签上包含软件版本时,必须通过PI传达(21 CFR 801.3、801.50(b);另见 78 FR 58794)。
来源:FDA,RAPS
站点声明:
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
河南岁福医疗科技有限公司专注于医疗器械、诊断试剂产品政策与法规规事务服务,提供产品注册申报代理、临床合同(CRO)研究、GMP质量辅导等方面的技术外包和生产许可证、经营许可证及临床机构备案办理服务。

相关文章

