24小时服务热线
13007546599
服务热线:13007546599
服务项目
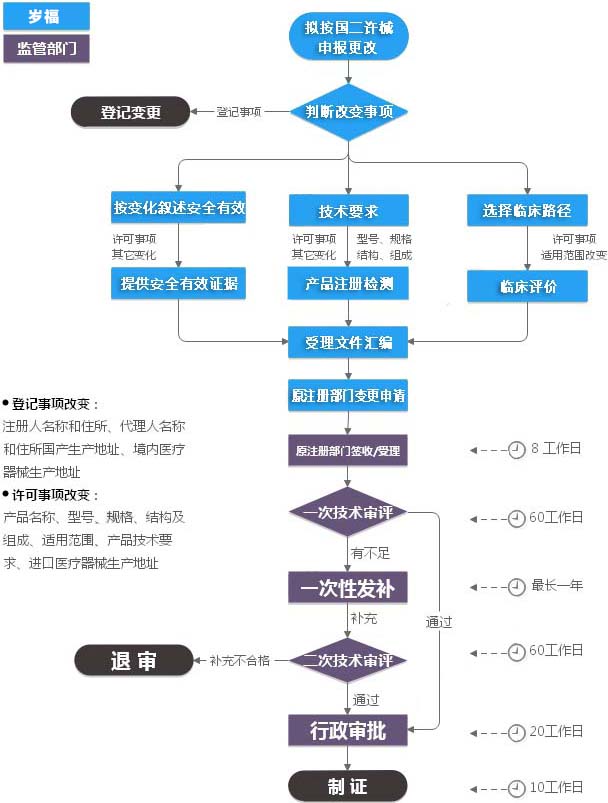
Products Classification根据《医疗器械注册管理办法》的规定,已注册的第二类医疗器械,医疗器械注册证及其附件载明的内容发生变化,注册人应当向原注册部门申请注册变更,并按照相关要求提交申报资料。 产品名称、型号、规格、结构及组成、适用范围、产品技术要求、进口医疗器械生产地址等发生变化的,注册人应当向原注册部门申请许可事项变更。二类医疗器械注册证许可事项变更,搞不定?我帮您!
1、《医疗器械注册证许可事项变更申请表》;
2、证明性文件:营业执照等;
3、注册人关于变更情况的声明;
4、原医疗器械注册证及附件复印件、历次医疗器械注册变更文件复印件;
5、变更申请项目申报资料要求(根据具体情况提交以下文件):
(1)产品名称变化的对比表及说明;
(2)产品技术要求变化的对比表及说明;
(3)型号、规格变化的对比表及说明;
(4)结构及组成变化的对比表及说明;
(5)产品适用范围变化的对比表及说明;
(6)注册证中“其他内容”变化的对比表及说明。
6、与产品变化相关的安全风险管理报告;
7、变化部分对产品安全性、有效性影响的资料;
8、针对产品技术要求变化部分的注册检验报告;
9、符合性声明。
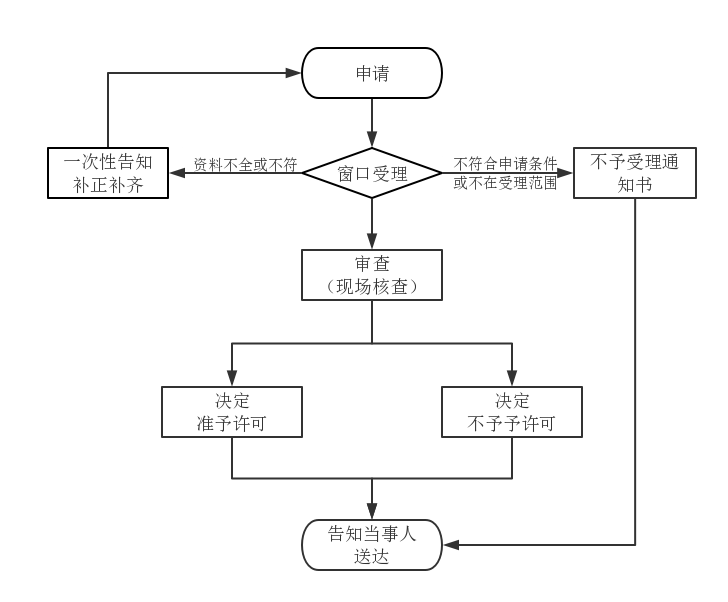
1、已取得注册证二类器械在销售的产品,要变更外壳颜色(仅颜色),有需要走什么流程的吗?需要注册变更吗?
答:外壳颜色变更不用做医疗器械注册变更,企业内部资料变更即可。
2、如果在北京市药监局变更医疗器械产品型号,需要怎么样的一个程序呀?办理变更程序是否简单?
答:办理变更相当于重新注册。增加型号属于许可事项变更,要是减型号属于登记事项变更。
3、已注册二类产品,在同一个注册单元内增加规格型号,还需要缴变更注册费吗?
答:增加型号属于许可事项变更,部分省份对二类医疗器械注册证许可事项变更收取变更费用,详见下方收费标准。
4、第二类医疗器械许可事项变更,省局还要现场核查注册质量体系吗?如果是生产场地变更呢?
答:许可事项变更一般不来,大部分省份不来。生产场地变更不是许可事项,这个是登记事项。在注册证时,这个是需要现场体考的。
备注
* 产品名称、型号、规格、结构及组成、适用范围、产品技术要求、进口医疗器械生产地址等发生变化的,注册人应当向原注册部门申请许可事项变更。
* 注册人名称和住所、代理人名称和住所发生变化的,注册人应当向原注册部门申请登记事项变更;境内医疗器械生产地址变更的,注册人应当在相应的生产许可变更后办理注册登记事项变更。
| 主管部门 | 管理类别 | 首次注册 |
注册变更 (许可事项变更) |
延续注册 (五年一次) |
实施日期 | ||
|---|---|---|---|---|---|---|---|
|
省 局 |
1 | 福建省 | Ⅱ | 5.77 | 2.42 | 2.39 | 2018/9/11 |
| 2 | 江西省 | Ⅱ | 5.467 | 2.289 | 2.268 | 2020/2/6 | |
| 3 | 上海市 | Ⅱ | 6.573 | 2.751 | 2.73 | 2018/5/9 | |
| 4 | 海南省 | Ⅱ | 5.81 | 2.408 | 2.387 | 2020/5/27 | |
| 5 | 山东省 | Ⅱ | 5.754 | 2.408 | 2.387 | 2020/08/21 | |
| 6 | 安徽省 | Ⅱ | 5.005 | 2.093 | 2.079 | 2019/10/22 | |
| 7 | 浙江省 | Ⅱ | 6.573 | 2.2008 | 2.184 | 2020/7/1至2020/12/31 | |
| 8 | 山西省 | Ⅱ | 4.2315 | 1.6275 | 1.6275 | 2020/4/16 | |
| 9 | 云南省 | Ⅱ | 4.28 | 1.75 | 1.75 | 2018/3/16 | |
| 10 | 河北省 | Ⅱ | 7.23 | 3.03 | 3 | 2016/10/1 | |
| 11 | 江苏省 | Ⅱ | 5.915 | 2.471 | 2.457 | 2019/2/13 | |
| 12 | 宁夏 | Ⅱ | 1.5 | 0.65 | 0.65 | 2019/12/18 | |
| 13 | 黑龙江 | Ⅱ | 5.76 | 2.416 | 2.4 | 2017/8/1 | |
| 14 | 广东省 | Ⅱ | 5.726 | 2.394 | 2.38 | 2019/2/25 | |
| 15 | 湖南省 | Ⅱ | 5.04 | 2.114 | 2.1 | 2019/4/11 | |
| 16 | 四川省 | Ⅱ | 3.95 | 1.65 | 1.65 | 2019/11/27 | |
| 17 | 贵州省 | Ⅱ | 4.29 | 1.76 | 1.76 | 2017/10/17 | |
| 18 | 广西 | Ⅱ | 7.57 | 3.16 | 3.14 | 2017/12/29 | |
| 19 | 辽宁省 | Ⅱ | 5 | 2.1 | 2.1 | 2020/6/12 | |
| 20 | 吉林省 | Ⅱ | 0 | 0 | 0 | 2020/2/8 | |
| 21 | 湖北省 | Ⅱ | 0 | 0 | 0 | ||
| 22 | 河南省 | Ⅱ | 0 | 0 | 0 | ||
| 23 | 重庆市 | Ⅱ | 0 | 0 | 0 | 2019/5/15 | |
| 24 | 甘肃省 | Ⅱ | 0 | 0 | 0 | ||
| 25 | 新疆 | Ⅱ | 0 | 0 | 0 | ||
| 26 | 内蒙古 | Ⅱ | 0 | 0 | 0 | 2019/9/17 | |
| 27 | 北京市 | Ⅱ | 0 | 0 | 0 | 2019/4/25 | |
| 28 | 天津市 | Ⅱ | 0 | 0 | 0 | 2019/1/4 | |
| 29 | 陕西省 | Ⅱ | 0 | 0 | 0 | 2020/1/10 | |
| 文件名称 | 文号 |
|---|---|
| 《医疗器械监督管理条例》 | 650号文件 |
| 《医疗器械注册管理办法》 | 局令4号 |
立项阶段
预算、合同、考虑期,约2个工作日。
受理前资料准备
产品添加新型号,需考虑检测。平均消耗6个月,视产品情况有所变化。(如无强标更新,则可免除检测。)
如需精算请联络思途。(免临床目录产品除外。)
注册变更资料编制可与检测并行,资料编写大致15个工作日。
省局受理期限,在5个工作日。
受理后
省局法定办结时限在3个月。(93工日,不计节假。)
发补时限0~2个月,考虑平均时间1个月。视变更资料具体情况而定。
预算合计
第二类医疗器械注册许可事项变更代办服务,预计完成在4.5~10.5个月。
| 注册变更申报资料编写服务 | 变更发补资料编写服务 |
| 药监跑腿(直到下证)服务 | 延伸:医疗器械临床试验服务 |
| 延伸:gmp年度辅导服务 | 延伸:二类医疗器械注册服务 |
站点声明:
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
河南岁福医疗科技有限公司专注于医疗器械、诊断试剂产品政策与法规规事务服务,提供产品注册申报代理、临床合同(CRO)研究、GMP质量辅导等方面的技术外包和生产许可证、经营许可证及临床机构备案办理服务。


