24小时服务热线
13007546599
服务热线:13007546599


美国的新药审批是世界上最严格规范的,一个公司通常需要花费5亿美元资金,用12到15年的时间才能将一个新药从试验室走入市场。在5000个临床前化合物中只有5个化合物可以进入临床试验,而5个化合物中只有一个能被批准用于临床治疗,成为真正的药物。
美国新药审评是在FDCA( Federal Food, Drug and Cosmetic Act, 联邦食品、药品、化妆品法案 )中规定的。尽管FDCA被许多人看来在这类法律中是最复杂的一个,但此法案有关新药审评最重要的条款却相当简单。首先,FDCA规定:用于诊断、治愈、缓解、预防人、其它动物疾病的物品;用于影响人、或其它动物身体的结构、或功能的物品(食品除外)为药品。FDCA还规定,任何新药在上市之前一定要表明它是安全、有效的以及经过审批。
从一个实验室发现的新化合物发展成为一个治疗疾病的药物,需要经过如下开发阶段:
首先是药物研发:药物研发公司发明了一种新药,寻求FDA的批准,以期在美国上市。
动物实验:药物研发公司必须对新药做动物毒性实验。多个物种被用来收集药物的毒性和有效性。
当一个化合物通过了临床前试验后,需要向FDA提交新药临床研究申请,以便可以将该化合物应用于人体试验。如果在提交申请后30天内FDA没有驳回申请,那么该新药临床研究申请即被视为有效,可以进行人体试验。新药临床研究申请需要提供先前试验的材料;以及计划将在什么地方,由谁以及如何进行临床试验的说明;新化合物的结构;投药方式;动物试验中发现的所有毒性情况;该化合物的制造生产情况。所有临床方案必须经过机构审评委员会(Institutional Revuew Board,IRB)的审查和通过。每年必须向FDA和IRB 汇报一次临床试验的进程和结果。
这一阶段的临床试验一般需要征集20-100名正常和健康的志愿者进行试验研究。试验的主要目的是提供该药物的安全性资料,包括该药物的安全剂量范围。同时也要通过这一阶段的临床试验获得其吸收、分布、代谢和排泄以及药效持续时间的数据和资料。
这一期的临床试验通常需要征集100-500名相关病人进行式验。其主要目的是获得药物治疗有效性资料。
这一期的临床试验通常需1000-5000名临床和住院病人,多在多个医学中心进行,在医生的严格监控下,进一步获得该药物的有效性资料和鉴定副作用,以及与其他药物的相互作用关系。该阶段试验一般采取多中心,安慰剂(或/和有效对照剂)对照和双盲法试验。第三期临床试验是整个临床试验中最主要的一步。
在完成所有三个阶段的临床试验并分析所有资料及数据,如证明该药物的安全性和有效性,则可以向 FDA提交新药申请。新药申请需要提供所有收集到的科学资料。通常一份新药申请材料可多达100000页,甚至更多!按照法规,FDA应在6个月内审评完新药申请。但是由于大部分申请材料过多,而且有许多不规范,因此往往不能在这么短的时间内完成。1999年对于单个化学分子药的审评时间平均为12.6个月。
总结会议:FDA和新药申请厂家开会,准备提交新药申请。
NDA 申请:NDA申请被FDA同意后,药物生产商就可以在美国上市。NDA包括所有的动物实验、临床试验数据和信息,当然也包括药物对人体的作用以及药物的制造工艺。
申请重审:NDA被接收后,FDA有60天的时间决定是否归档,所以NDA要被重审。如果FDA觉得你的申请资料不完整,会拒绝归档。
标签检查:检查标签是否有误导性信息。
设备检验:检查生产设备
药物申请通过:FDA通过药物申请
一旦FDA批准新药申请后,该药物即可正式上市销售,供医生和病入选择。但是还必须定期向FDA呈交有关资料,包括该药物的副作用情况和质量管理记录。对于有些药物FDA还会要求做第四期临床试验,以观测其长期副作用情况。
因为在临床阶段不可能对所有的药物副作用进行风险评估,所以在药物上市后监控药物的安全性至关重要。生产商必须把相关信息提交给FDA。
FDA有一个药物监控自愿系统,该系统可以让医生和消费者很容易的报告不良药物事件。通常明显的不良危害被发现后,该不良风险会被加入药物的标签中,公众也可以通过其他途径被告知。有些药物需要减量,极少数的药物需要从市场回收。
2019年5月2日,美国FDA药物评估和研究中心(CDER)主任珍妮特·伍德科克(Janet Woodcock)在食品和药物法规研究所年会上向与会者表示,FDA将在未来两年内推进新药申请(NDAs)和生物制品许可申请(BLAs)评审现代化。
CDER正在拟定和实施与这项现代化计划相关的六项积极措施,包括针对上市申请的综合评审方案、研究性新药申请(即新药临床试验申请,IND)评审管理、上市后安全性管理、评估人才(伍德科克表示CDER仍然人员不足),重组管理和行政管理运作。
新的综合评估程序目前正在逐步实施,并将在2020年开始CDER在所有部门中采用,涉及制定简化的跨学科评审程序和标准模式,用于评估NDAs和BLA。
伍德科克说,这些标准模式和流程将以议题为基础,减少和消除冗余和效率低下的工作,促进跨学科间合作,以实现更好的知识管理。
这项现代化计划还将包括开发一种从新药申请前直至审核结束,对整个评审周期进行全程跟踪的工具,以便审核小组能系统地掌握所有情况和问题。
伍德科克还表示:CDER还将充实两类新的成员,便于评审人员对新药申请和生物制品许可的科学监管方,包括(1)临床数据科学家-支持安全性分析和(2)医学编辑-提供编辑和格式化服务。
这项现代化计划将使领导层能早期参与讨论药品已知的利益和风险问题,以及侧重于具体审查问题的联合评估会议。
根据伍德科克的说法,将在今年夏天开始的IND管理将使审查变得更方便,他们将涉及开发“一种基于风险的方法对申报文件和修订资料进行分类,并确定它们是否纳入优先程序,以及时迅速进行评审。”
2020秋季,CDER将致力于创建一个标准化的上市后药物安全性框架,将包括跨学科协作和科学评估内容。
至于即将采取的与仿制药有关的举措,CDER正在制定关于橙皮书、治疗等效性和Hatch-Waxman(药品市场)排他性的指导文件。
在生物仿制药方面,最终版的可互换性指南预计将在2019年5月17日之前完成,而比较分析评估的修订草案预计将在2019年5月21日之前完成。届时可以予以关注。
此外,预计还会对FDA的紫皮书进行修改更新,同时重新评估FDA关于提交和审查BLA的规定,以确保它们能够解释当前的做法和权限。
伍德科克说:“更新后的法规将为原创产品和生物仿制药/可互换产品的制造商提供更高的清晰度和监管确定性,并有助于防止出现可能阻碍或延迟竞争的'游戏'。”
临床二期挂掉的:(2008-2010)
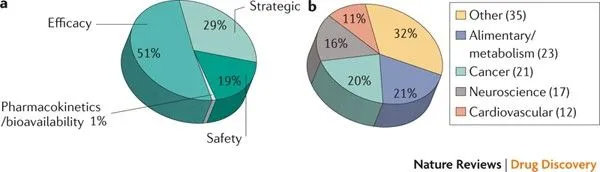
总共108个挂掉的药物
a.挂掉的原因。b.挂掉的哪方面药物
由Centre for Medicines Research (CMR)分析的16家药物公司(占据药物研发市场60%的费用)的新药研发成功率从(2006–2007) 的28%降到了(2008–2009)的18%。
临床三期和申请不通过的:(2007-2010)
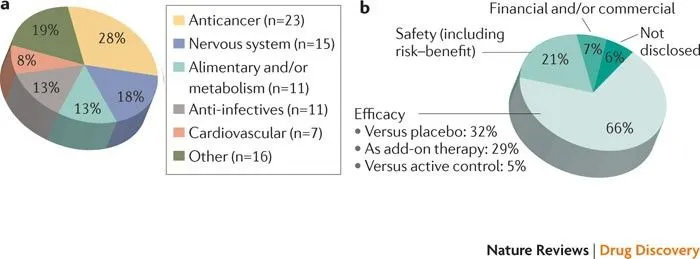
总共83个挂掉的药物
a.挂掉的哪方面药物。b.挂掉的原因
由Centre for Medicines Research (CMR)分析临床三期的成功率已经降到50%。
以上数据都来至:Trial Watch
下一篇:伦理审查SOP文件什么时候修改?
站点声明:
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
河南岁福医疗科技有限公司专注于医疗器械、诊断试剂产品政策与法规规事务服务,提供产品注册申报代理、临床合同(CRO)研究、GMP质量辅导等方面的技术外包和生产许可证、经营许可证及临床机构备案办理服务。

相关文章

